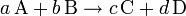Enseñar no es transferir conocimiento; sino crear las posibilidades para su propia construcción.
jueves, 12 de noviembre de 2015
CATÁLISIS
es el proceso por el cual se aumenta la velocidad de una reacción química, debido a la participación de una sustancia llamada CATALIZADOR y las que desactivan la catálisis son denominados inhibidores. Un concepto importante es que el catalizador no se modifica durante la reacción química, lo que lo diferencia de un reactivo.
es el proceso por el cual se aumenta la velocidad de una reacción química, debido a la participación de una sustancia llamada CATALIZADOR y las que desactivan la catálisis son denominados inhibidores. Un concepto importante es que el catalizador no se modifica durante la reacción química, lo que lo diferencia de un reactivo.
CARACTERÍSTICAS: la reacción catalítica tiene un menor cambio de energía libre de la etapa limitante hasta el estado de transición que la reacción no catalizada correspondiente, resultando en una mayor velocidad de reacción a la misma temperatura.
Cinéticamente, las reacciones catalíticas se comportan como las reacciones químicas típicas, es decir, la velocidad de reacción depende de la frecuencia de contacto de los reactivos en la etapa determinante de velocidad
EJEMPLOS DE REACCIONES QUÍMICAS
La característica de una reacción química es que al combinarse los reactivos siempre existe un intercambio de energía, ya sea que ésta se libere al medio ambiente para formar los productos, o que sea necesario aplicar energía para que se lleve a cabo la reacción química.
reacción química:
Reacción Ácido Base:
- 2HCl + Zn –> ZnCl2 + H2
- NaOH + HCL –> NaCl + H2O
- Fe(OH)2 + H2SO4 –> FeSO4 + H2O
- CuO + 2HCL –> CuCl2 + H2O
Reacción de Combustión:
- O2 + C –> CO2
- 2SH2 + 3O2 –> 2SO2 + 2H2O
- Cu + O2 –> CuO2
Reacción de Oxidación:
- 2Fe + O2 = 2FeO
- 4Al + 3O2 = 2Al203
- 2Mg + O2 –> 2MgO
El producto de una reacción química es una substancia de naturaleza totalmente diferente a la de los reactivos.
miércoles, 11 de noviembre de 2015
METÁTESIS
es una reacción en la que los átomos de carbono del doble enlace se intercambian entre sí. Es un proceso intra o intermolecular entre 2 olefinas (también posible entre 2 alquinos o una olefina y un alquino) que da lugar a un intercambio entre las dos unidades del alqueno.
Para que la metátesis se pueda llevar a cabo necesitamos un catalizador metálico. Éstos son complejos de un metal de transición (generalmente de Mo o Ru) del tipo LnM=R (o LnM≡R para 2 alquinos) que han sido desarrollados por Robert H. Grubbs y Richard R. Schrock.
Reducción-Oxidación
reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación.
Para que exista una reacción de reducción-oxidación, en el sistema debe haber un elemento que ceda electrones, y otro que los acepte:
- El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir, siendo oxidado.
- El agente oxidante es el elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido.
REACCIÓN ENDOTERMCA
Si hablamos de entalpía (H), una reacción endotérmica es aquella que tiene un incremento de entalpía o ΔH positivo. Es decir, la energía que poseen los productos es mayor a la de los reactivos.
EJEMPLO:
Un ejemplo de reacción endotérmica es la producción del ozono (O3). Esta reacción ocurre en las capas altas de la atmósfera, gracias a la radiación ultravioleta proporcionada por la energía del Sol. También se produce esta reacción en las tormentas, en las proximidades de las descargas eléctricas.
3O2 + ENERGÍA → 2O3 ; ΔH > 0
REACCIÓN EXOTERMICA
Se denomina reacción exotérmica a cualquier reacción química que desprenda energía, ya sea como luz o calor,1 o lo que es lo mismo: con una variación negativa de la entalpía; . Por lo tanto se entiende que las reacciones exotérmicas liberan energía. Considerando que A, B, C y D representen sustancias genéricas, el esquema general de una reacción exotérmica se puede escribir de la siguiente manera:
Son cambios exotérmicos las transiciones de gas a líquido (condensación) y de líquido a sólido (solidificación).
Un ejemplo de reacción exotérmica es la combustión.
La reacción contraria, que consume energía, se denomina reacción endotérmica
ECUACIÓN QUÍMICA
es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (llamadas reactivos o reactantes) y las sustancias que se originan (llamadas productos).
INTERPRETACIÓN DE UNA ECUACIÓN QUÍMICA
Un caso general de ecuación química sería:
donde:
- A, B, C, D, representan los símbolos químicos o la fórmula molecular de los átomos o moléculas que reaccionan (lado izquierdo) y los que se producen (lado derecho).
- a, b, c, d, representan los coeficientes estequiométricos, que deben ser ajustados de manera que sean reflejo de la ley de conservación de la masa.
- Cuando "a" átomos (o moléculas) de A reaccionan con "b" átomos (o moléculas) de B producen "c" átomos (o moléculas) de C, y "d" átomos (o moléculas) de D.
- Cuando "a" moles de átomos (o moléculas) de A reaccionan con "b" moles de átomos (o moléculas) de B producen "c" moles de átomos (o moléculas) de C, y "d" moles de átomos (o moléculas) de D.
La interpretación física de los coeficientes estequiométricos, si estos son números enteros y positivos, puede ser en átomos o moles. Así, se diría de la ecuación de geometría estequiométrica se subdivide en la siguiente:
El símbolo "+" se lee como "reacciona con", mientras que el símbolo "→" se lee como "produce". Para ajustar la ecuación, ponemos los coeficientes estequiométricos:
La ecuación está ajustada y puede ser interpretada como 2 mol de moléculas de hidrógeno reaccionan con 1 mol de moléculas de oxígeno, produciendo 2 mol de moléculas de agua.
Las fórmulas químicas a la izquierda de la fecha de reacción ( "→" )representan las sustancias reaccionantes o reactantes
Adicionalmente, se pueden agregar (entre paréntesis y como subíndice) el estado de agregación molecular de cada sustancia participante: sólido (s), líquido (l), acuoso (ac) o gaseoso (g).
Ecuación Química: representa la transformación de sustancias.
Reactante(s) à Producto(s)
|
Tipos de Reacciones Químicas
Las reacciones químicas pueden clasificarse de manera sencilla en cinco grandes grupos. Existen otras clasificaciones, pero para predicción de los productos de una reacción, esta clasificación es la más útil.
Reacciones de Síntesis o Composición
En estas reacciones, dos o más elementos o compuestos se combinan, resultando en un solo producto.
Síntesis Química: la combinación de dos o mas sustancias para formar un solo compuesto.
A + B à C
(donde A y B pueden ser elementos o compuestos)
|
Ejemplo:
Dos elementos se combinarán para formar el compuesto binario correspondiente. En este caso, el aluminio y el oxígeno formarán el óxido de aluminio. La ecuación que representa la reacción es la siguiente:
4 Al (s) + 3 O2 (g) à 2 Al2O3 (s)
Estas reacciones son inversas a la síntesis y son aquellas en la cuales se forman dos o más productos a partir de un solo reactante, usualmente con la ayuda del calor o la electricidad.
Descomposición Química: la formación de dos o mas sustancias a partir de un solo compuesto.
A à B + C
(donde B y C pueden ser elementos o compuestos)
|
Ejemplo:
Un compuesto binario se descompone en los elementos que lo conforman. En este caso, el óxido de mercurio (II) se descompone para formar los elementos mercurio y oxígeno. La ecuación que representa la reacción es la siguiente:
2 HgO (s) à 2 Hg (l) + O2 (g)
Estas reacciones son aquellas en las cuales un átomo toma el lugar de otro similar pero menos activo en un compuesto. En general, los metales reemplazan metales (o al hidrógeno de un ácido) y los no metales reemplazan no metales. La actividad de los metales es la siguiente, en orden de mayor actividad a menor actividad: Li, K, Na, Ba, Ca, Mg, Al, Zn, Fe, Cd, Ni, Sn, Pb, (H), Cu, Hg, Ag, Au. El orden de actividad de los no metales mas comunes es el siguiente: F, O, Cl, Br, I, siendo el flúor el más activo.
Desplazamiento Químico: un elemento reemplaza a otro similar y menos activo en un compuesto.
AB + C à CB + A ó AB + C à AC + B
(dónde C es un elemento más activo que un metal A o un no metal B)
|
Ejemplo :
El magnesio es un metal más activo que el cobre y por tanto, lo reemplazará en el compuesto, formando sulfato de magnesio. A la vez, el cobre queda en su estado libre como otro producto de la reacción. La ecuación que representa la reacción es la siguiente:
Mg (s) + CuSO4 (ac) à MgSO4 (ac) + Cu (s)
Reacciones de Doble Desplazamiento o Intercambio
Estas reacciones son aquellas en las cuales el ión positivo (catión) de un compuesto se combina con el ión negativo (anión) del otro y viceversa, habiendo así un intercambio de átomos entre los reactantes. En general, estas reacciones ocurren en solución, es decir, que al menos uno de los reactantes debe estar en solución acuosa.
Doble Desplazamiento Químico: los reactantes intercambian átomos – el catión de uno se combina con el anión del otro y viceversa.
AB + CD à AD + CB
|
ejemplo:
En esta reacción, la plata reemplaza al hidrógeno del ácido, formando cloruro de plata. Al mismo tiempo, el hidrógeno reemplaza a la plata, formando ácido nítrico con el nitrato. La ecuación que representa la reacción es la siguiente:
AgNO3 (ac) + HCl (ac) à HNO3 (ac) + AgCl (s)
domingo, 8 de noviembre de 2015
REACCIÓN QUÍMICA
es todo proceso termodinámico en el cual una o más sustancias(llamadas reactantes), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
Suscribirse a:
Entradas (Atom)